

 更多“在酸碱滴定中标准溶液的浓度一般与被测物质的浓度相近,它们的浓…”相关的问题
更多“在酸碱滴定中标准溶液的浓度一般与被测物质的浓度相近,它们的浓…”相关的问题
A.以HCl标准溶液滴定某碱样。所用滴定管因未洗净,滴定时管内壁挂有液滴
B.以K2Cr2O7为基准物,用碘量法标定Na2S2O3溶液的浓度时,滴定速度过快,并过早读出滴定管读数
C.标定标准溶液的基准物质,在称量时吸潮了(标定时用直接法)
D.EDTA标准溶液滴定钙镁含量时,滴定速度过快
A.NH4Cl(Kb(NH3)=1.8×10-5)
B.H2SO4
C.HAc(Ka=1.8×10-5)
D.HCOOH(Ka=1.8×10-4)
A.用于标定标准溶液的基准物在称量时吸潮了
B.以HCl标准溶液滴定某碱样,所用滴定管未用原液润洗
C.以EDTA标准溶液滴定钙镁含量时,滴定速度过快
D.以失去部分结晶水的硼砂为基准物,标定盐酸溶液的浓度
MnO4-及MnO42-岐化生成的MnO4-和MnO2全部还原为Mn2+,剩余的Fe2+溶液用上述KMnO4标准溶液滴定至终点,消耗24.00mL.计算试液中HCOOH和HOAc的浓度各为多少?
现有KNO3和NaNO2的混合样品5.000g,制备成500.0mL的溶液,移液25.00mL,用浓度为0.1200mol·L-1的Ce4+标准溶液50.00mL在强酸中氧化,过量的Ce4+用浓度为0.02500mol·L-1的Fe2+标准溶液滴定,用去Fe2+溶液28.40mL,相应的反应如下:
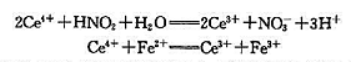
(1)若将第一个反应式作为原电池的电池反应写出该原电池的电极反应并计算该电池反应的ΔrGmθ[已知ϕθ(Ce4++/Ce3+)=1.44V,ϕθ(NO3-/NO2-)=0.934V]
(2)计算试样中NaNO2的质量分数w.[已知M(NaNO2)=69.00g.mol-1]
(3)计算第一步的标准平衡常数Kθ.
解题思路:注意原电池的写法.此题依然是考查电化与热力学、化学平衢间的计算.