

 更多“已知在1mol·L-1H2SO4溶液中,(Ce4+/Ce3+…”相关的问题
更多“已知在1mol·L-1H2SO4溶液中,(Ce4+/Ce3+…”相关的问题
苯乙烯在60℃以过氧化二叔丁基为引发剂,苯为溶剂进行溶液聚合。当单体苯乙烯的浓度c(M)=1mol/L,引发剂浓度c(I)=0.01mol/L时,引发和聚合的初速分别为4×10-11mol/(L·s)和1.5×10-7mol/(L·s)。试根据计算判断低转化率下,在上述聚合反应中链终止的主要方式,真正终止和链转移终止的比例。已知:60℃时CM=8.0×10-5,CI=3.2×10-4,CS=2.3×10-6,苯乙烯的密度为0.887g/mL,苯的密度为0.839g/mL。设苯乙烯苯体系为理想溶液。
A.重铬酸钾容易提纯,在140-150℃干燥后,可直接称量配制标准溶液,不需进行标定
B.重铬酸钾标准溶液非常稳定,可以长期保存
C.可在1mol/L HCl溶液中滴定Fe(Ⅱ)
D.重铬酸钾的氧化能力比高锰酸钾强
判断以下说法是否正确,并说明理由:
(1)某无素相对原子质量就是该元素一个原子的质量.
(2)碳有二种同位素: ,因此,碳的相对原子量等于12C原子质量、13C原子质量、14C原子质量之和的1/3.
,因此,碳的相对原子量等于12C原子质量、13C原子质量、14C原子质量之和的1/3.
(3)在58.44gNaCl中,有NA个NaCl分子.
(4)某溶液浓度为1mol·dm3时,表示1dm3溶液中含某溶质的摩尔数为1mol.
(5)1mol某物质的质量,称为该物质的“摩尔质量”.
(6)一定量气体的体积与温度成正比.
(7)1mol任何气体体积都是22.4L.
(8)混合气体中各组分气体的体积百分组成与其摩尔分数相等.
A.浓度为0.1mol/l
B.浓度为1mol/l
C.含NAOH4g
D.含NAOH0.1mol
钒具有下列几种氧化态,其还原电势可用c(H+)=1mol·dm-3时的元素电势图表示:
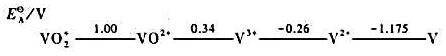
①钒如能溶解在稀酸中,将以何种氧化态存在?试写出化学反应方程式。
②写出V3+/V电对的Eθ。
③在这些不同氧化态物质间能否发生歧化反应?如能发生请写出化学反应方程式。
④将V放入含有V3+的溶液中,有无反应发生?若有请写出化学反应方程式。
在HgCl2=HgCl++Cl-体系中,已知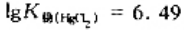 ,请计算在0.01mol·dm-3升汞溶液中的电离度及[HgCl+]/[HgCl2]的比值.
,请计算在0.01mol·dm-3升汞溶液中的电离度及[HgCl+]/[HgCl2]的比值.
已知
