

 更多“在1 mol·L-1 H2SO4溶液中,Ce4+/Ce3+的…”相关的问题
更多“在1 mol·L-1 H2SO4溶液中,Ce4+/Ce3+的…”相关的问题
 (Ag2CrO4)=1.1×10-12,在0.10mol·L-1Ag+溶液中,要产生Ag2CrO4沉淀,
(Ag2CrO4)=1.1×10-12,在0.10mol·L-1Ag+溶液中,要产生Ag2CrO4沉淀, 的浓度至少应大于( )
的浓度至少应大于( )A.1.1×10-10mol·L-1
B.2.25×10-11mol·L-1
C.0.10mol·L-1
D.1×10-11mol·L-1
下列溶液中能否产生沉淀?(1)0.020mol·L-1BaCl2溶液与0.010mol·L-1Na2CO3溶液等体积混合;(2)0.050mol·L-1MgCl2溶液与0.10mol·L-1氨水等体积混合;(3)在0.10mol·L-1HAc和0.10mol·L-1FeCl2混合溶液中通人H2S气体达饱和(约0.10mol·L-1).
在660K时,反应
2NO(g)+O2(g)→2NO2(g)
的实验数据如下:
初始浓度/(mol·L-1) | 初始速率/(mol·L-1·s-1) (NO消耗速率) | |
c(NO) | c(O2) | |
0.010 | 0.010 | 2.5×10-3 |
0.010 | 0.020 | 5.0×10-3 |
0.030 | 0.020 | 45×10-3 |
(1)写出该反应的速率方程式,该反应的反应级数是多少?
(2)计算速率常数。
(3)当c(NO)=0.015mol·L-1,c(O2)=0.025mol·L-1时,反应速率为多少?
在CSTR反应器中,A被转化成C,反应速率方程为
-rA=0.15cA式中rA的单位为mol·L-1·s-1。

当在Ⅰ中盛Hg(1)时,测得电阻为0.99895Ω(1Ω是273.15K时,截面积为1mm2、长为1062.936mm的Hg(1)柱的电阻);当Ⅰ和Ⅱ中均盛以浓度约为3mol·dm-3的H2SO4溶液时,测得Ⅱ的电阻为Ⅰ的0.107811倍。若Ⅱ中盛以浓度为1.0mol·dm-3的KCl溶液时,测得电阻为17565Ω。试求:

CO(CH2COOH)2在水溶液中分解成丙酮和二氧化碳,分解反应的速率 常数在283K时为1.08×10-4mol·L-1·s-1,在333K时为5.48×10-2mol·L-1·s-1,试计算在303K时分解反应的速率常数。
A.1.0×10-4mol·L-1
B.1.0×10-7mol·L-1
C.0.10mol·L-1
D.1.0X10-12mol·L-1
现有KNO3和NaNO2的混合样品5.000g,制备成500.0mL的溶液,移液25.00mL,用浓度为0.1200mol·L-1的Ce4+标准溶液50.00mL在强酸中氧化,过量的Ce4+用浓度为0.02500mol·L-1的Fe2+标准溶液滴定,用去Fe2+溶液28.40mL,相应的反应如下:
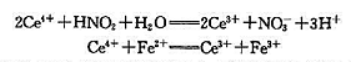
(1)若将第一个反应式作为原电池的电池反应写出该原电池的电极反应并计算该电池反应的ΔrGmθ[已知ϕθ(Ce4++/Ce3+)=1.44V,ϕθ(NO3-/NO2-)=0.934V]
(2)计算试样中NaNO2的质量分数w.[已知M(NaNO2)=69.00g.mol-1]
(3)计算第一步的标准平衡常数Kθ.
解题思路:注意原电池的写法.此题依然是考查电化与热力学、化学平衢间的计算.
在1mol·L-1H2SO4溶液中,以0.05mol·L-1的Ce4+溶液滴定0.05moI·L-1的Fe2+,化学计量点时电势为1.06V(滴定突跃的电势为0.86~1.26V),选择哪种滴定措示剂最好?( )

A.4.75
B.3.75
C.2.75
D.5.75